Negli ultimi anni lo studio dell’epigenetica, cioè dei cambiamenti dell’espressione dei geni in seguito a stimoli ambientali, ha chiarito molti aspetti dei meccanismi legati all’espressione genica. Oggi sappiamo che in natura tutti gli organismi viventi ricevono stimoli dall’ambiente e che questi possono cambiare il modo in cui i geni si “accendono” o si “spengono”.
Nonostante il cammino della scienza sia ancora lungo, lo studio dei meccanismi epigenetici sta già rispondendo a molte domande che i ricercatori si ponevano da tempo. Le più importanti riguardano forse lo sviluppo di malattie metaboliche: come può l’ambiente influenzare l’insorgenza di queste patologie? Quanto è importante questa influenza esterna sull’espressione dei geni che condizionano il nostro comportamento alimentare e il nostro metabolismo?
Da vari studi, recenti e non, è noto che il rischio di obesità è influenzato dalla relazione dinamica fra l’ambiente, la genetica e le prime fasi di sviluppo del bambino. In particolare, a destare preoccupazione è l’obesità infantile con le sue conseguenze a breve e lungo termine, viste le dimensioni e la diffusione del fenomeno e il relativo aumento della spesa sanitaria.
L’analisi delle relazioni fra epigenetica e sviluppo di obesità è ancora in corso, ma esaminare queste prime idee iniziali, su cosa e come si può cambiare, potrebbe condurre a nuove soluzioni per la prevenzione dell’obesità infantile.
Uno degli studi epidemiologici più importanti al riguardo è quello relativo alla carestia olandese del 1944, seguita dall’aumento del rischio di obesità, ipertensione, diabete tipo II e addirittura disturbi psicopatologici come schizofrenia e depressione, nei discendenti. I meccanismi con cui questo aumentato rischio era trasmesso erano meccanismi epigenetici: nei feti esposti alla restrizione calorica materna, rispetto ai nati nei periodi precedenti o seguenti la carestia, c’era quindi una maggiore incidenza delle suddette patologie. Questo fenomeno è stato interpretato come un meccanismo ad alto significato evolutivo: l’organismo in formazione registra le caratteristiche dell’ambiente in cui crescerà e si adatta, a costo di ammalarsi in seguito con maggiore probabilità. Dunque, l’epigenetica ha un’influenza importante sulle origini dell’obesità, dallo sviluppo fetale ai primissimi anni di vita.
Alcuni gruppi di ricerca si sono concentrati in modo specifico sulla nutrizione materna e paterna. Studi su topi geneticamente identici esposti in utero a diete materne differenti mostrano che si possono sviluppare fenotipi molto diversi, includendo differenti pesi e differenti conformazioni fisiche. In particolare, topi che dovrebbero normalmente essere obesi acquisiscono un fenotipo magro se la loro madre è esposta a una dieta fortificata con colina, acido folico e vitamina B12, che influenzano la metilazione del DNA in un locus genetico particolare. Analogamente, in vari modelli animali, diete ad alto tenore di grasso durante la gestazione risultano associate a diverse espressioni geniche relative al metabolismo lipidico, a quello glucidico, alla regolazione dell’appetito. Questa espressione genetica alterata può influenzare il metabolismo lipidico e carboidratico della prole, con influenze sul fenotipo delle generazioni successive. Alcuni di questi effetti possono essere mitigati se la nutrizione post natale è correttamente bilanciata e, in particolare, se ha una adeguata composizione lipidica.
L’alimentazione materna durante la gestazione influenza anche il microbiota* della madre e dei suoi figli. In uno studio giapponese sui macachi, ad esempio, madri alimentate con tipica dieta occidentale, ricca di grassi animali, subiscono una traslazione verso specie del microbiota che influenzano il metabolismo lipidico e attivano meccanismi pro infiammatori. Questa modificazione si registra anche nella prole.
Alcuni studi sostengono inoltre che anche l’alimentazione paterna abbia un ruolo importante, poiché modificazioni epigenetiche sembrano agire sulle caratteristiche dello spermatozoo che fertilizza l’oocita. Nei ratti, ad esempio, una dieta paterna ad alto tenore di grassi provocava una disfunzione delle beta cellule pancreatiche nelle femmine della prole. Anche l’obesità paterna sembra influenzare la salute metabolica a riproduttiva della prole per molte generazioni. È chiaro, dunque, che l’alimentazione dei genitori può rappresentare un fattore epigenetico di grande impatto sul fenotipo comportamentale e metabolico della prole.
Questa mole di conoscenze, ancora in via di approfondimento e sviluppo, può contribuire ad approntare, in modo mirato ed efficace, progetti di prevenzione dell’obesità infantile, attraverso programmi di informazione e sensibilizzazione a partire dai percorsi di accompagnamento alla nascita, passando per quelli di supporto all’allattamento naturale e procedendo con l’educazione alimentare in età scolare e nell’adolescenza.
Note
*la comunità di organismi unicellulari che vive in stretta associazione con il nostro organismo.
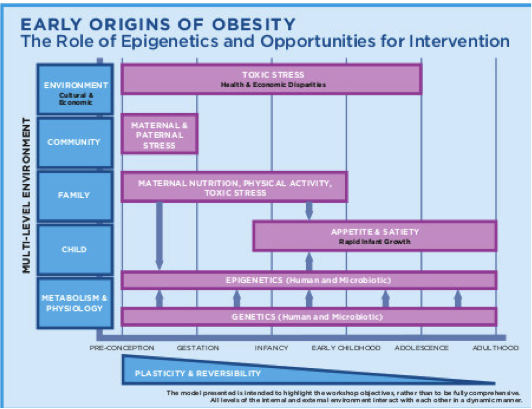
LA seconda immagine è tratta da IOM (Institute of Medicine). 2015. Examining a developmental approach to childhood obe- sity: The fetal and early childhood years: Workshop summary. Washington, DC: The National Academies Press.
Riferimenti e approfondimenti:
Joss-Moore LA et al. 2015. Epigenetic contributions to the developmental origins of adult lung disease. Biochem Cell Biol;93:119-27.
Lane RH. Fetal programming, epigenetics, and adult onset disease. Clin Perinatol 2014;41:815-31.
Majnik AV, Lane RH. 2015. The relationship between early-life environment, the epigenome and the microbiota. Epigenomics;7:1173-84.
Dobbs, D. 2013. The social life of genes. Pacific Standard, September 3.
Lillycrop, K. A., and G. C. Burdge. 2011. Epigenetic changes in early life and future risk of obesity. International Journal of Obesity 35(1):72-83.
Peterson J. Et al. 2009. The NIH human microbiome project. Genome Research 19(12):2317-2323.
Friedman J. E. 2015. Obesity and gestational diabetes mellitus pathways for programming in mouse, monkey, and man—where do we go next? The 2014 Norbert Freinkel Award lecture. Diabetes Care 38(8):1402-1411.
Kumar H. et al. 2014. Gut microbiota as an epigenetic regulator: Pilot study based on whole-genome methylation analysis. MBio 5(6): e02113-e02114.
Lane M. et al. 2015. Peri-conception parental obesity, reproductive health, and transgenerational impacts. Trends in Endocri- nology and Metabolism 26(2):84-90.
Informazioni su sedi, orari e modalità operative dello studio nutrizionale